如何調節非必要性的免疫反應
|
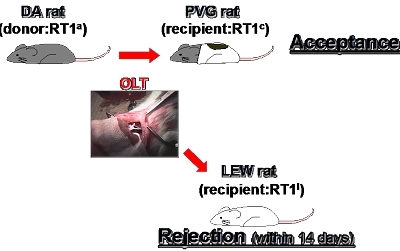
如何調節非必要性的免疫反應 臨床醫學研究所 中野敏明副教授 在感染過程中,我們的免疫系統必須辦認入侵的病原體,並活化先天性免疫,啟動後天性免疫來移除入侵的病原體。相反地在自體免疫疾病、過敏及器官移植後 的排斥現象,我們則需要抑制這些免疫反應。免疫調節是非常難以控制的,例如過度的免疫抑制,可能增加感染風險以及癌症發生。本人自 2004 年加入高雄長庚紀念醫院肝臟移植研究團隊,致力於研究移植排斥與耐受性相關之免疫調節的議題。此報告, 將概述目前對核抗原及其抗體在排斥與耐受性的了解,以核抗原作為診斷及治療目標的重要性。 細胞、組織或是器官移植已廣泛地應用在治療有生命威脅的疾病或是創傷性傷害。然而,除了自體移植或是完全相同的雙胞胎外,我們需要考慮移植後的排斥。到目前為止,有幾種免疫抑制藥物如 tacrolimus(FK506)和 cyclosporine 可有效地抑制移植後的排斥現象;但是伴隨而來的是嚴重副作用以及長期的服藥。所以,發展更安全及更有效的免疫抑制劑和預測排斥產生的診斷方法 ,進而提升移植後病人與家屬生活品質是一個重要的課題。在我們所建立的實驗性肝臟移植模式組合,受肝者大鼠可以在沒有免疫抑制劑的使用下,自然克服排斥反應並接受捐肝大鼠的肝臟,包括自然耐受性模式[DA 大鼠(MHC haplotype:RT1a)的肝臟移植到 PVG 大鼠(RT1c)體內:DA-PVG]以及急性排斥模式[DA 大鼠移植到 LEW 大鼠(RT1l)]。利用這些動物肝臟移植模式,我們在受肝者的血清與肝臟組織中找到數個與排斥/耐受性相關的基因、蛋白質及微小核糖核酸。值得注意的是,發現抗組織蛋白(histone H1)抗體在排斥過程中短暫上升(Transplantation 2004)是研究的轉捩點。 為何大鼠 DA-PVG 的肝臟移植組合會自然克服排斥呢?到現在還是個問號,但是我們或許可以用核抗原及其抗核抗體,來解釋其中一個免疫調節機制。手術傷害、缺血再灌流之傷害及移植後排斥造成核抗原,由受損細胞或活化的免疫細胞釋放,可能引起先天性及後天性免疫反應(Clin Dev Immunoll 2013)。我們推測核抗原的敏感性或許是決定肝臟移植被接受或排斥的一個主要因素。簡單來說,PVG 大鼠經由 histone H1 的接種產生了抗 histone H1 抗體,另一方面,LEW 大鼠卻無法被誘發產生抗 histone H1 抗體(Transplant Immunol 2008)。如果受肝者是自體免疫動物模式或病人(表示病人對核抗原特別敏感),他們或許可以在低劑量或不使用免疫抑制劑的處理下,而接受移植來的肝臟。 核抗原釋放進入血液中也與幾種疾病發展相關,包括感染疾病、發炎失調、惡性腫瘤及創傷。為了預防核抗原的釋放,很多治療策略被提出。其中一個方法是使用抗 histone H1、HMGB1 及 RAGE 的中和抗體。特別是抗 HMGB1 及抗 RAGE 抗體在實驗性敗血症、肝臟缺血再灌流之傷害、肝炎、創傷性大腦傷害及器官移植上具有治療之潛力。我們的研究團隊發展新型抗 histone H1 單株抗體,也驗證此抗體在器官移植(J Immunol 2009)、實驗性敗血症(BioMed Res Int 2015)以及過敏(尚未發表)之治療潛力;同時將結果發表在國際期刊上。 綜合上述,核抗原對於引起先天性及後天性免疫反應是非常重要的。因此,核抗原對於調節非必要的免疫反應,可作為重要的診斷指標和治療目標。另外,我們在核抗原引起幹細胞增生與分化的實驗結果中發現,其對於組織修復及再生也具有良好的功能(J Cell Physiol 2012)。所以,如何調節自體免疫(例如活化抗核抗體產生)與同種異體免疫(例如經由核抗原產生的先天性及後天性免疫反應)之平衡,對於以預防或治療方式調節非必要性免疫反應與免疫耐受性產生是重要的課題。 |