癌症醫療的新選擇-簡介質子治療
癌症醫療的新選擇-簡介質子治療
醫放系 李宗其助理教授
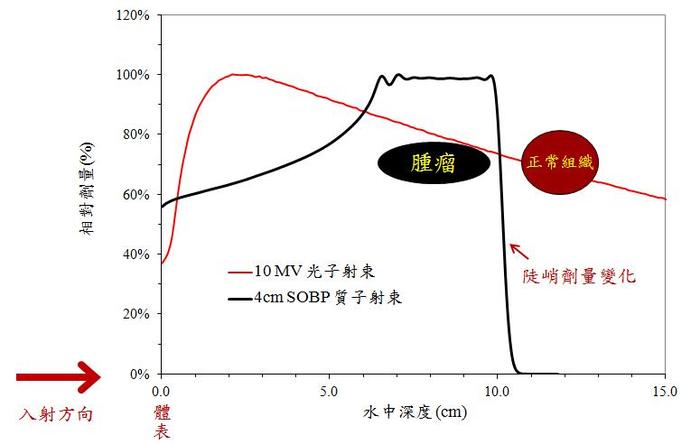
不論何種放射治療技術,其主要目標皆在提高腫瘤與週邊正常組織間的劑量差異 (dose gradient) 以達到劑量集中在腫瘤本身,並盡可能降低週邊正常組織劑量 (副作用) 的目的。傳統光子治療射束會直接穿透人體 ( 圖一,紅線代表射束在不同深度沉積的劑量百分比 ),因此除了腫瘤所在深度會有輻射劑量外,腫瘤前後的正常組織也無可避免會接受到放射劑量。現代光子治療技術運用非常複雜的照射參數操控技術 ( 入射角度、能量、強度調控等 ),可以在某種程度上滿足提高腫瘤劑量並降低正常組織劑量的目標。
質子治療應用高能質子射束會停在特定深度的特性 ( 由圖一黑線代表 ),可藉由治療深度的控制額外增加一個劑量操控的自由度,理論上應可產生比傳統光子治療更好的劑量分佈。相較於傳統光子治療,質子射束的特性提供更廣闊的應用空間,也有機會大幅降低各種輻射副作用的影響 ( 如圖一,正常組織幾乎沒有受到劑量 )。近年來昂貴的質子治療設施如雨後春筍般在世界各地成立。根據粒子治療合作組織 (Particle Therapy Co-Operative Group, PTCOG) 的統計,直到 2016 年 11 月止全世界共有 68 座粒子治療設施正在運行,而在台灣目前有七個質子或重離子中心 ( 十五個治療室 ) 獲得衛福部許可正在規劃或建造中。長庚醫院質子中心更已於 2015 年年底正式接受病患,提供常規治療服務。然而擁有這麼優異劑量特性的質子治療技術為何仍無法全面取代傳統光子治療?除了現有設備造價昂貴的因素之外,是否仍有其他原因限制其大量應用?
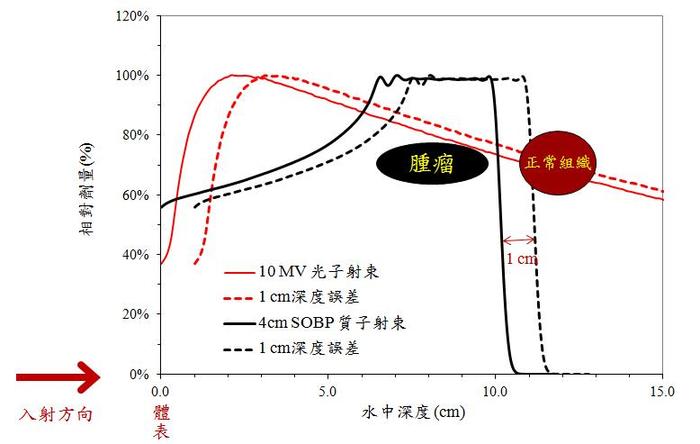
質子射束的有限射程特性在理論上雖可形成劑量集中的優勢,但因在穿透深度末端劑量的陡峭變化 ( 見圖一 ),使其對深度不確定性所造成的劑量誤差敏感度亦大為增加。以圖二的說明為例,光子射束在深度方向1公分的位置誤差所造成的劑量差異僅有幾個百分比 ( 比較紅色實線與虛線 );但對質子射束而言,錯誤的穿透深度預測可使後方組織劑量由 0 變成 100% ( 比較黑色實線與虛線 ) 而產生極高的治療風險。造成質子射程計算誤差的可能因素有很多,其中包含物理、治療技術、生理及輻射生物等因素。目前為止,世界各國質子治療中心在臨床處理射程不確定性時,多半在射束穿透方向加上射程乘以 3.5%+1-3 mm 的額外安全邊距,來避免治療不確定性所造成的腫瘤劑量不足或正常組織誤照 (Paganetti / 2012, Engelsman / 2013)。也就是說,當無法確認射束在病患體內的真正停止深度時,就以加大照射範圍的保守策略來處理射程不確定性的問題。這勢必會犧牲掉治療的有效性或安全性,並使耗費鉅資的質子治療設施無法發揮其最大的優勢。
為了降低射程不確定性對臨床質子治療的限制、由長庚大學及長庚醫院共同支持成立的放射科學研究院,在洪志宏及董傳中兩位院長的領導下,提出發展直接瞬發伽馬光子及反向加馬的偵測系統以進行質子射程驗證的跨院校整合型研究計劃。參與單位涵蓋長庚醫院放射腫瘤科、長庚大學醫放系及電子系。此外,醫放系放射治療實驗室亦嘗試利用以質子攝影技術進行質子治療射程驗證的初步研究。種種努力皆希望能推進質子治療的安全性,進一步改善現有技術的限制以真正發揮質子治療的優勢。